

jusqu'au 30 Avril
La première étape avant de pouvoir réaliser votre rêve d’avoir un enfant dans nos cliniques en Espagne.
Les traitements de reproduction médicalement assistée s’adressent aussi bien aux couples présentant des problèmes de fertilité (infertilité masculine, infertilité féminine ou les deux) qu’à des femmes célibataires et ou couples de femmes souhaitant avoir un enfant.

La Procréation Médicalement Assistée (PMA) est l’ensemble de techniques et traitements médicaux destinés à favoriser la grossesse lorsqu’il existe des problèmes de fertilité masculins, féminins ou des deux partenaires.
Au fil des dernières années, cette discipline médicale a aidé aussi des femmes qui souhaitent vivre la maternité de manière individuelle, sans avoir un partenaire, ou des couples de femmes qui souhaitent être mères. On parle, donc, d’une spécialité de la médecine qui est en train de créer de nouveaux modèles de famille.
Voir tous

Le prix de chaque traitement de procréation médicalement assistée est appliqué en fonction de sa technicité. Les traitements de PMA aujourd’hui proposés par IVI sont l’insémination artificielle, la Fécondation In Vitro (FIV), la FIV Genetic, le Don d’ovocytes et la préservation de fertilité.
Plus d'informations
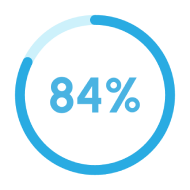
Les taux de réussite d’IVI, audités par une entreprise indépendante, sont possibles grâce à notre engagement dans la recherche scientifique, grâce à la qualité de tous nos procédés, grâce aux plus de 1900 publications scientifiques consacrées à résoudre les problèmes d’infertilité et, surtout, grâce à la vaste formation de tous nos spécialistes. Ces éléments réunis nous permettent d’offrir à nos patients les meilleurs résultats, année après année.

IVI, centre leader en médecine reproductive, offre les meilleures techniques et traitements de reproduction médicalement assistée en Espagne. Une équipe pluridisciplinaire se tiendra à vos côtés durant tout le processus dans nos cliniques francophones.
IVI est la première clinique espagnole entièrement consacrée à la reproduction assistée. Depuis 1990 nous avons grandi grâce à la confiance accordée par nos patients mais aussi par des spécialistes en gynécologie et en reproduction assistée.

IVI tient à fournir un accueil personnalisé à ses patientes. Nous avons bien compris qu’il ne s’agit pas uniquement de traiter des problèmes médicaux, mais, avant tout, des êtres humains.
Nous vous accueillons et vous accompagnons en français tout au long de votre parcours de maternité et nous mettons à votre disposition les connaissances et l’expérience de nombreux spécialistes de renommée mondiale, connus pour leurs travaux scientifiques et leurs résultats cliniques.

Il est impossible de voir le début de cette vidéo sans être ému par les larmes de bonheur de Carole ou la voix agitée de Raphaël. Il s’agit des parents de Lilou, qui joue avec insouciance sans jamais lâcher leur main.
Ce couple s’est adressé à IVI Madrid après cinq ans de traitements de fertilité infructueux en France, ce qui ne les avait pourtant pas fait perdre espoir. Ils avaient plus de 40 ans, mais ils étaient déterminés à fonder une famille et ils l’ont donc transmis à l’équipe médicale. La surprise est venue quand ils ont entendu une réponse claire et directe : « Mais si, c’est possible. Il y a toute une démarche qui fonctionne bien et ça fait des années que ça marche comme ça chez nous ». Ils se sont tournés alors l’un vers l’autre, le sourire aux lèvres.
Carole Berthelot & Raphael Moreau